Бор
Бор химический элемент
| Бор / Borium (B) | |
|---|---|
| Атомный номер | 5 |
| Внешний вид простого вещества |
 |
| Свойства атома | |
|
Атомная масса (молярная масса) |
10,811 а.е.м. (г/моль) |
| Радиус атома | 98 пм |
|
Энергия ионизации (первый электрон) |
800,2(8,29) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p1 |
| Химические свойства | |
| Ковалентный радиус | 82 пм |
| Радиус иона | 23 (+3e) пм |
|
Электроотрицательность (по Полингу) |
2,04 |
| Электродный потенциал | — |
| Степени окисления | 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 2,34 г/см³ |
| Молярная теплоёмкость | 11,09 Дж/(K·моль) |
| Теплопроводность | 27,4 Вт/(м·K) |
| Температура плавления | 2573 K |
| Теплота плавления | 23,60 кДж/моль |
| Температура кипения | 3931 K |
| Теплота испарения | 504,5 кДж/моль |
| Молярный объём | 4,6 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | ромбоэдрическая |
| Параметры решётки | a=10,17; α=65,18 Å |
| Отношение c/a | 0,576 |
| Температура Дебая | 1250 K |
| B | 5 |
| 10,811 | |
| [He]2s22p1 | |
| Бор | |
Бор— элемент главной подгруппы третьей группы, второго периода периодической системы химических элементов Д.И.Менделеева, с атомным номером 5. Обозначается символом B (Borium). В свободном состоянии бор— бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.
История и происхождение названия химического элемента Бор
Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3.
Получение
Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
1. Метод металлотермии (чаще восстановление магнием или натрием):


2. Термическое разложение паров бромида бора на раскаленной (1000—1200°C) танталовой проволоке в присутствии водорода:

Физические свойства
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химический бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
 .
.
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором— фосфид BP, с углеродом— карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:

С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов с кислотой:
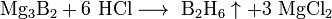
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:

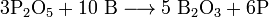
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты  .
.
Оксид бора  — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
— типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
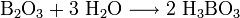
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты— бораты (содержащие анион BO33-), а тетрабораты, например:
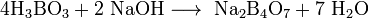
Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2-) Технический продукт содержит до 10,4% «активного кислорода», на их основе производят отбеливатели, «не содержащие хлор» («персиль», «персоль» и др.).
Отдельно также стоит указать на то что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме нитрида углерода, алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике.
Борная кислота (H3BO3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде, применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путем изменения ее концентрации в теплоносителе— так называемое «борное регулирование».
Бороводороды и борорганические соединения
Ряд органических производных бора (бороводороды) являются чрезвычайно эффективными ракетными топливами (диборан(B2H4), пентаборан, тетраборан и др.), а некоторые полимерные соединения с водородом и углеродом являются чрезвычайно стойкими к химическим воздействиям и высоким температурам, например широко известный пластик Карборан-22.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)•10 – 4% бора, в костной ткани (1,1—3,3)•10 – 4%, в крови— 0,13мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза— 4г.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Бор, Borum, В (5)
Природные соединения бора (Boron, франц. Воге, нем. Bor), главным образом нечистая бура, известны с раннего средневековья. Под названиями тинкал, тинкар или аттинкар (Tinkal, Tinkar, Attinkar) бура ввозилась в Европу из Тибета; она употреблялась для пайки металлов, особенно золота и серебра. В Европе тинкал назывался чаще боракс (Воrax) от арабского слова bauraq и персидского — burah. Иногда боракс, или борако, обозначал различные вещества, например соду (нитрон). Руланд (1612) называет боракс хризоколлой — смолой, способной «склеивать» золото и серебро. Лемери (1698) тоже называет боракс «клеем золота» (Auricolla, Chrisocolla, Gluten auri). Иногда боракс обозначал нечто вроде «узды золота» (capistrum auri). В Александрийской эллинистической и византийской химической литературе борахи и борахон, а также в арабской (bauraq) обозначали вообще щелочь, например bauraq arman (армянский борак), или соду, позже так стали называть буру.
В 1702 г. Гомберг, прокаливая буру с железным купоросом, получил «соль» (борную кислоту), которую стали называть «успокоительной солью Гомберга» (Sal sedativum Hombergii); эта соль нашла широкое применение в медицине. В 1747 г. Барон синтезировал буру из «успокоительной соли» и натрона (соды). Однако состав буры и «соли» оставался неизвестным до начала XIX в. В «Химической номенклатуре» 1787 г. фигурирует название horacique асid (борная кислота). Лавуазье в «Таблице простых тел» приводит (radical boracique). В 1808 г. Гей-Люссаку и Тенару удалось выделить свободный бор из борного ангидрида, нагревая последний с металлическим калием в медной трубке; они предложили назвать элемент бора (Вога) или бор (Воге). Дэви, повторивший опыты Гей-Люссака и Тенара, тоже получил свободный бор и назвал его бораций (Boracium). В дальнейшем у англичан это название было сокращено до Boron. В русской литературе слово бура встречается в рецептурных сборниках XVII — XVIII вв. В начале XIX в. русские химики называли бор буротвором (Захаров, 1810), буроном (Страхов,1825), основанием буровой кислоты, бурацином (Севергин, 1815), борием (Двагубский, 1824). Переводчик книги Гизе называл бор бурием (1813). Кроме того, встречаются названия бурит, борон, буронит и др.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | ---- | VIIIB | ---- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
