Азот
| Азот | |
|---|---|
| Атомный номер | 7 |
| Внешний вид простого вещества |
Газ без цвета вкуса и запаха, химически весьма инертен |
| Свойства атома | |
|
Атомная масса (молярная масса) |
14,00674 а. е. м. (г/моль) |
| Радиус атома | 92 пм |
|
Энергия ионизации (первый электрон) |
1401,5 (14,53) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p3 |
| Химические свойства | |
| Ковалентный радиус | 75 пм |
| Радиус иона | 13 (+5e) 171 (-3e) пм |
|
Электроотрицательность (по Полингу) |
3,04 |
| Электродный потенциал | — |
| Степени окисления | 5, 4, 3, 2, 1, 0, -1, -3 |
| Термодинамические свойства простого вещества | |
| Плотность | 0,808 (−195,8 °C) г/см³ |
| Молярная теплоёмкость | 29,125 (газ N2) Дж/(K·моль) |
| Теплопроводность | 0,026 Вт/(м·K) |
| Температура плавления | 63,29 K |
| Теплота плавления | (N2) 0.720 кДж/моль |
| Температура кипения | 77,4 K |
| Теплота испарения | (N2) 5.57 кДж/моль |
| Молярный объём | 17,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая |
| Параметры решётки | 5,661 Å |
| Отношение c/a | — |
| Температура Дебая | n/a K |
| N | 7 |
| 14,00674 | |
| [He]2s22p3 | |
| Азот | |
Азот — элемент главной подгруппы пятой группы второго периода периодической системы химических элементов Д. И. Менделеева с атомным номером 7. Обозначается символом N (Nitrogenium). Простое вещество азот (CAS-номер: 7727-37-9) — достаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха (формула N2).
Открытие
В 1777 году Генри Кавендиш провёл следующий опыт: он многократно пропускал воздух над раскалённым углём, затем обрабатывал его щёлочью, в результате получался остаток, который Кавендиш назвал удушливым (или мефитическим) воздухом. С позиций современной химии ясно, что в реакции с раскалённым углём кислород воздуха связывался в углекислый газ, который затем реагировал со щёлочью. При этом остаток газа представлял собой по большей части азот. Таким образом, Кавендиш выделил азот, но не сумел понять, что это новое простое вещество (химический элемент). В том же году Кавендиш сообщил об этом опыте Джозефу Пристли.
Пристли в это время проводил серию экспериментов, в которых также связывал кислород воздуха и удалял полученный углекислый газ, то есть также получал азот, однако, будучи сторонником господствующей в те времена теории флогистона, совершенно неверно истолковал полученные результаты (по его мнению, процесс был противоположным — не кислород удалялся из газовой смеси, а наоборот, в результате обжига воздух насыщался флогистоном; оставшийся воздух (азот) он и назвал насыщенным флогистоном, то есть флогистированным). Очевидно, что и Пристли, хотя и смог выделить азот, не сумел понять сути своего открытия, поэтому и не считается первооткрывателем азота.
Одновременно схожие эксперименты с тем же результатом проводил и Карл Шееле.
В 1772 году азот (под названием «испорченного воздуха») как простое вещество описал Даниэль Резерфорд, он опубликовал магистерскую диссертацию, где указал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и считается первооткрывателем азота.
В дальнейшем азот был изучен Генри Кавендишем (интересен тот факт, что он сумел связать азот с кислородом при помощи разрядов электрического тока, а после поглощения оксидов азота в остатке получил небольшое количество газа, абсолютно инертного, хотя, как и в случае с азотом, не смог понять, что выделил новые химические элементы — инертные газы). Однако и Резерфорд был сторонником флогистонной теории, поэтому также не смог понять, что же он выделил. Таким образом, чётко определить первооткрывателя азота невозможно.
Происхождение названия
Азот ( ἀζωτος — безжизненный, Nitrogenium), вместо предыдущих названий («флогистированный», «мефитический» и «испорченный» воздух) предложил в 1787 году Антуан Лавуазье, который в то время в составе группы других французских учёных разрабатывал принципы химической номенклатуры. Как показано выше, в то время уже было известно, что азот не поддерживает ни горения, ни дыхания. Это свойство и сочли наиболее важным. Хотя впоследствии выяснилось, что азот, наоборот, крайне необходим для всех живых существ, название сохранилось во французском и русском языках.
Существует и иная версия. Слово «азот» придумано не Лавуазье и не его коллегами по номенклатурной комиссии; оно вошло в алхимическую литературу уже в раннем средневековье и употреблялось для обозначения «первичной материи металлов», которую считали «альфой и омегой» всего сущего. Это выражение заимствовано из Апокалипсиса: «Я есмь Альфа и Омега, начало и конец». Слово составлено из начальных и конечных букв алфавитов трёх языков — латинского, греческого и древнееврейского, — считавшихся «священными», поскольку, согласно Евангелиям, надпись на кресте при распятии Христа была сделана на этих языках (а, альфа, алеф и зет, омега, тав — AAAZOTH). Составители новой химической номенклатуры хорошо знали о существовании этого слова; инициатор её создания Гитон де Морво отмечал в своей «Методической энциклопедии» (1786) алхимическое значение термина.
На латыни азот называется «Nitrogenium», то есть «рождающий селитру»; английское название производится от латинского. В немецком языке используется название Stickstoff, что означает «удушающее вещество».
Азот в природе
Изотопы азоты
Природный азот состоит из двух стабильных изотопов 14N — 99,635 % и 15N — 0,365 %.
Известны радиоактивные изотопы азота с массовыми числами 11, 12, 13, 16 и 17. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13N имеет период полураспада 10 мин.
Магнитный момент ядер изотопов 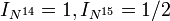
Распространённость
Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на Уране, Нептуне, межзвёздном пространстве и др. Азот — четвёртый по распространённости элемент Солнечной системы (после водорода, гелия и кислорода).
Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму), то есть около 3,87·1015 т.
Содержание азота в земной коре, по данным разных авторов, составляет (0,7—1,5)·1015 т (причём в гумусе — порядка 6·1010 т), а в мантии Земли — 1,3·1016 т. Такое соотношение масс заставляет предположить, что главным источником азота служит верхняя часть мантии, откуда он поступает в другие оболочки Земли с извержениями вулканов.
Масса растворённого в гидросфере азота, учитывая, что одновременно происходят процессы растворения азота атмосферы в воде и выделения его в атмосферу, составляет около 2·1013 т, кроме того примерно 7·1011 т азота содержатся в гидросфере в виде соединений.
Биологическая роль
Азот является элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2%, по массовой доле — около 2,5 % (четвертое место после водорода, углерода и кислорода). В связи с этим значительное количество связанного азота содержится в живых организмах, «мёртвой органике» и дисперсном веществе морей и океанов. Это количество оценивается примерно в 1,9·1011 т. В результате процессов гниения и разложения азотсодержащей органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие азот, например, «чилийская селитра» (нитрат натрия с примесями других соединений), норвежская, индийская селитры.
Круговорот азота в природе
Фиксация атмосферного азота в природе происходит по двум основным направлениям — абиогенному и биогенному. Первый путь включает главным образом реакции азота с кислородом. Так как азот химически весьма инертен, для окисления требуются большие количества энергии (высокие температуры). Эти условия достигаются при разрядах молний, когда температура достигает 25000 °C и более. При этом происходит образование различных оксидов азота. Существует также вероятность, что абиотическая фиксация происходит в результате фотокаталитических реакций на поверхности полупроводников или широкополосных диэлектриков (песок пустынь).
Однако основная часть молекулярного азота (около 1,4·108 т/год) фиксируется биотическим путём. Долгое время считалось, что связывать молекулярный азот могут только небольшое количество видов микроорганизмов (хотя и широко распространённых на поверхности Земли): бактерии Azotobacter и Clostridium, клубеньковые бактерии бобовых растений Rhizobium, цианобактерии Anabaena, Nostoc и др. Сейчас известно, что этой способностью обладают многие другие организмы в воде и почве, например, актиномицеты в клубнях ольхи и других деревьев (всего 160 видов). Все они превращают молекулярный азот в соединения аммония (NH4+). Этот процесс требует значительных затрат энергии (для фиксации 1 г атмосферного азота бактерии в клубеньках бобовых расходуют порядка 167,5 кДж, то есть окисляют примерно 10 г глюкозы). Таким образом, видна взаимная польза от симбиоза растений и азотфиксирующих бактерий — первые предоставляют вторым «место для проживания» и снабжают полученным в результате фотосинтеза «топливом» — глюкозой, вторые обеспечивают необходимый растениям азот в усваиваемой ими форме.
Азот в форме аммиака и соединений аммония, получающийся в процессах биогенной азотфиксации, быстро окисляется до нитратов и нитритов (этот процесс носит название нитрификации). Последние, не связанные тканями растений (и далее по пищевой цепи травоядными и хищниками), недолго остаются в почве. Большинство нитратов и нитритов хорошо растворимы, поэтому они смываются водой и в конце концов попадают в мировой океан (этот поток оценивается в 2,5—8·107 т/год).
Азот, включённый в ткани растений и животных, после их гибели подвергается аммонификации (разложению содержащих азот сложных соединений с выделением аммиака и ионов аммония) и денитрификации то есть выделению атомарного азота, а также его оксидов. Эти процессы целиком происходят благодаря деятельности микроорганизмов в аэробных и анаэробных условиях.
В отсутствие деятельности человека процессы связывания азота и нитрификации практически полностью уравновешены противоположными реакциями денитрификации. Часть азота поступает в атмосферу из мантии с извержениями вулканов, часть прочно фиксируется в почвах и глинистых минералах, кроме того, постоянно идёт утечка азота из верхних слоёв атмосферы в межпланетное пространство.
Токсикология азота и его соединений
Сам по себе атмосферный азот достаточно инертен, чтобы оказывать непосредственное влияние на организм человека и млекопитающих. Тем не менее, при повышенном давлении он вызывает наркоз, опьянение или удушье (при недостатке кислорода); при быстром снижении давления азот вызывает кессонную болезнь.
Многие соединения азота очень активны и нередко токсичны.
Получение
В лабораториях его можно получать по реакции разложения нитрита аммония:
Реакция экзотермическая, идёт с выделением 80 ккал (335 кДж), поэтому требуется охлаждение сосуда при её протекании (хотя для начала реакции требуется нагревание нитрита аммония).
Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
Выделяющийся при этом газ загрязнён аммиаком, оксидом азота (I) и кислородом, от которых его очищают, последовательно пропуская через растворы серной кислоты, сульфата железа (II) и над раскалённой медью. Затем азот осушают.
Ещё один лабораторный способ получения азота — нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). Реакция идёт по уравнениям:
Самый чистый азот можно получить разложением азидов металлов:
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами, получают путём реакции воздуха с раскалённым коксом:
При этом получается так называемый «генераторный», или «воздушный», газ — сырьё для химических синтезов и топливо. При необходимости из него можно выделить азот, поглотив монооксид углерода.
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот». Также широко применяются азотные установки, в которых используется метод адсорбционного и мембранного газоразделения.
Один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре ~700°С:
Аммиак берут из его насыщенного раствора при нагревании. Количество CuO в 2 раза больше расчётного. Непосредственно перед применением азот очищают от примеси кислорода и аммиака пропусканием над медью и её оксидом (II) (тоже ~700°C), затем сушат концентрированной серной кислотой и сухой щёлочью. Процесс происходит довольно медленно, но он того стоит: газ получается весьма чистый.
Свойства
Физические свойства
При нормальных условиях азот это бесцветный газ, не имеет запаха, мало растворим в воде (2,3 мл/100г при 0 °C, 0,8 мл/100г при 80 °C).
В жидком состоянии (темп. кипения -195,8 °C) – бесцветная, подвижная, как вода, жидкость. При контакте с воздухом поглощает из него кислород.
При -209,86 °C азот переходит в твердое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
Известны три кристаллические модификации твёрдого азота. В интервале 36,61 – 63,29 К существует фаза β-N2 с гексагональной плотной упаковкой, пространственная группа P63/mmc, параметры решётки a=3,93 Å и c=6,50 Å. При температуре ниже 36,61 К устойчива фаза α-N2 с кубической решёткой, имеющая пространственную группу Pa3 или P213 и период a=5,660 Å. Под давлением более 3500 атмосфер и температуре ниже 83 K образуется гексагональная фаза γ-N2.
Химические свойства, строение молекулы
Азот в свободном состоянии существует в форме двухатомных молекул N2, электронная конфигурация которых описывается формулой σs²σs*2πx, y4σz², что соответствует тройной связи между молекулами азота N≡N (длина связи dN≡N = 0,1095 нм). Вследствие этого молекула азота крайне прочна, для реакции диссоциации N2 ↔ 2N удельная энтальпия образования ΔH°298=945 кДж, константа скорости реакции К298=10-120, то есть диссоциация молекул азота при нормальных условиях практически не происходит (равновесие практически полностью сдвинуто влево). Молекула азота неполярна и слабо поляризуется, силы взаимодействия между молекулами очень слабые, поэтому в обычных условиях азот газообразен.
Даже при 3000 °C степень термической диссоциации N2 составляет всего 0,1 %, и лишь при температуре около 5000 °C достигает нескольких процентов (при нормальном давлении). В высоких слоях атмосферы происходит фотохимическая диссоциация молекул N2. В лабораторных условиях можно получить атомарный азот, пропуская газообразный N2 при сильном разряжении через поле высокочастотного электрического разряда. Атомарный азот намного активнее молекулярного: в частности, при обычной температуре он реагирует с серой, фосфором, мышьяком и с рядом металлов, например, со ртутью.
Вследствие большой прочности молекулы азота многие его соединения эндотермичны, энтальпия их образования отрицательна, а соединения азота термически малоустойчивы и довольно легко разлагаются при нагревании. Именно поэтому азот на Земле находится по большей части в свободном состоянии.
Ввиду своей значительной инертности азот при обычных условиях реагирует только с литием:
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:
Наибольшее практическое значение имеет нитрид водорода (аммиак):
Промышленное связывание атмосферного азота
Соединения азота чрезвычайно широко используются в химии, невозможно даже перечислить все области, где находят применение вещества, содержащие азот: это индустрия удобрений, взрывчатых веществ, красителей, медикаментов и проч. Хотя колоссальные количества азота доступны в прямом смысле слова «из воздуха», из-за описанной выше прочности молекулы азота N2 долгое время оставалась нерешённой задача получения соединений, содержащих азот, из воздуха; большая часть соединений азота добывалась из его минералов, таких, как чилийская селитра. Однако сокращение запасов этих полезных ископаемых, а также рост потребности в соединениях азота заставил форсировать работы по промышленному связыванию атмосферного азота.
Наиболее распространён аммиачный способ связывания атмосферного азота. Обратимая реакция синтеза аммиака:
экзотермическая (тепловой эффект 92 кДж) и идёт с уменьшением объёма, поэтому для сдвига равновесия вправо в соответствии с принципом Ле Шателье — Брауна необходимо охлаждение смеси и высокие давления. Однако с кинетической точки зрения снижение температуры невыгодно, так как при этом сильно снижается скорость реакции — уже при 700 °C скорость реакции слишком мала для её практического использования.
В таких случаях используется катализ, так как подходящий катализатор позволяет увеличить скорость реакции без сдвига равновесия. В процессе поиска подходящего катализатора было испробовано около двадцати тысяч различных соединений. По совокупности свойств (каталитическая активность, стойкость к отравлению, дешевизна) наибольшее применение получил катализатор на основе металлического железа с примесями оксидов алюминия и калия. Процесс ведут при температуре 400—600°С и давлениях 10—1000 атмосфер.
Следует отметить, что при давлениях выше 2000 атмосфер синтез аммиака из смеси водорода и азота идёт с высокой скоростью и без катализатора. Например, при 850 °C и 4500 атмосфер выход продукта составляет 97 %.
Существует и ещё один, менее распространённый способ промышленного связывания атмосферного азота — цианамидный метод, основанный на реакции карбида кальция с азотом при 1000 °C. Реакция происходит по уравнению:
Реакция экзотермична, её тепловой эффект 293 кДж.
Ежегодно из атмосферы Земли промышленным путём отбирается примерно 1·106 т азота. Подробно процесс получения азота изложен здесь ГРАСИС
Соединения азота
- Степени окисления азота в соединениях −3, −2, −1, +1, +2, +3, +4, +5.
Соединения азота в степени окисления −3 представлены нитридами, из которых практически наиболее важен аммиак;
Соединения азота в степени окисления −2 менее характерны, представлены пернитридами, из которых самый важный пернитрид водорода N2H4 или гидразин (существует также крайне неустойчивый пернитрид водорода N2H2, диимид);
Соединения азота в степени окисления −1 NH2OH (гидроксиламин) — неустойчивое основание, применяющееся, наряду с солями гидроксиламмония, в органическом синтезе;
Соединения азота в степени окисления +1 оксид азота (I) N2O (закись азота, веселящий газ);
Соединения азота в степени окисления +2 оксид азота (II) NO (монооксид азота);
Соединения азота в степени окисления +3 оксид азота (III) N2O3, азотистая кислота, производные аниона NO2-, трифторид азота NF3;
Соединения азота в степени окисления +4 оксид азота (IV) NO2 (диоксид азота, бурый газ);
Соединения азота в степени окисления +5 — оксид азота (V) N2O5, азотная кислота и её соли — нитраты, и др.
Использование и применение
Жидкий азот применяется как хладагент и для криотерапии.
Промышленные применения газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует окислению, гниению. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы. В производстве электроники азот применяется для продувки областей, не допускающих наличия окисляющего кислорода. Если в процессе, традиционно проходящем с использованием воздуха, окисление или гниение являются негативными факторами — азот может успешно заместить воздух.
Важной областью применения азота является его использование для дальнейшего синтеза самых разнообразных соединений, содержащих азот, таких, как аммиак, азотные удобрения, взрывчатые вещества, красители и т. п. Большие количества азота используются в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения, хладагент, а жидкий азот применяется при розливе масел и негазированных напитков для создания избыточного давления и инертной среды в мягкой таре.
Жидкий азот нередко демонстрируется в кинофильмах в качестве вещества, способного мгновенно заморозить достаточно крупные объекты. Это широко распространённая ошибка. Даже для замораживания цветка необходимо достаточно продолжительное время. Это связано отчасти с весьма низкой теплоёмкостью азота. По этой же причине весьма затруднительно охлаждать, скажем, замки до −196 °C и раскалывать их одним ударом.
Литр жидкого азота, испаряясь и нагреваясь до 20 °C, образует примерно 700 литров газа. По этой причине жидкий азот хранят в специальных сосудах Дьюара с вакуумной изоляцией открытого типа или криогенных ёмкостях под давлением. На этом же факте основан принцип тушения пожаров жидким азотом. Испаряясь, азот вытесняет кислород, необходимый для горения, и пожар прекращается. Так как азот, в отличие от воды, пены или порошка, просто испаряется и выветривается, азотное пожаротушение — самый эффективный с точки зрения сохранности ценностей механизм тушения пожаров.
Заморозка жидким азотом живых существ с возможностью последующей их разморозки проблематична. Проблема заключается в невозможности заморозить (и разморозить) существо достаточно быстро, чтобы неоднородность заморозки не сказалась на его жизненных функциях. Станислав Лем, фантазируя на эту тему в книге «Фиаско», придумал экстренную систему заморозки азотом, в которой шланг с азотом, выбивая зубы, вонзался в рот астронавта и внутрь его подавался обильный поток азота.
Маркировка баллонов
Баллоны с азотом окрашены в чёрный цвет, должны иметь надпись жёлтого цвета и коричневую полосу(нормыРоссийской Федерации).
Дополнительные материалы:
Соединения азота
Оксиды азота
Аммиак
Азотная кислота
Гидразин
Гидроксид аммония
Селитры
Нитраты
Азотистый обмен почвы
Криогенная резка
Азот, Nitrogenium, N (7)
Азот (Nitrogen, франц. Azote, нем. Stickstoff) был открыт почти одновременно несколькими исследователями. Кавендиш получил азот из воздуха (1772), пропуская последний через раскаленный уголь, а затем через раствор щелочи для поглощения углекислоты. Кавендиш не дал специального названия новому газу, упоминая о нем как о мефитическом воздухе (Air mephitic от латинского mephitis — удушливое или вредное испарение земли). Вскоре Пристлей установил, что если в воздухе долгое время горит свеча или находится животное (мышь), то такой воздух становится непригодным для дыхания. Официально открытие азота обычно приписывается ученику Блэка — Рутерфорду, опубликовавшему в 1772 г. диссертацию (на степень доктора медицины), — «О фиксируемом воздухе, называемом иначе удушливым», где впервые описаны некоторые химические свойства азота. В ати же годы Шееле получил азот из атмосферного воздуха тем же путем, что и Кавендиш. Он назвал новый 'газ испорченным воздухом (Verdorbene Luft). Поскольку пропускание воздуха через раскаленный уголь рассматривалось химиками-флогистиками как его флогистирование, Пристлей (1775) назвал азот флогистированным воздухом — Air phlogisticated. О флогистировании воздуха в своем опыте говорил ранее и Кавендиш. Лавуазье в 1776 — 1777 гг. подробно исследовал состав атмосферного воздуха и установил, что 4/5 его объема состоят из удушливого газа (Аir mofette — атмосферный мофетт, или просто Mofett). Названия азота — флогистированный воздух, мефитический воздух, атмосферный мофетт, испорченный воздух и некоторые другие — употреблялись до признания в европейских странах новой химической номенклатуры, т. е. до выхода в свет известной книги «Метод химической номенклатуры» (1787).
Составители этой книги — члены номенклатурной комиссии Парижской академии наук — Гитон де Морво, Лавуазье, Бертолле и Фуркруа — приняли лишь несколько новых названий простых веществ, в частности, предложенные Лавуазье названия «кислород» и «водород». При выборе нового названия для азота комиссия, исходившая из принципов кислородной теории, оказалась в затруднении. Как известно, Лавуазье предлагал давать простым веществам такие названия, которые отражали бы их основнйе химические свойства. Соответственно этому азоту следовало бы дать название «радикал нитрик» или «радикал селитряной кислоты». Такие названия, пишет Лавуазье в своей книге «Начала элементарной химии» (1789), основаны на старых терминах нитр или селитра, принятых в искусствах, в химии и в обществе. Они были бы весьма подходящими, но известно, что азот является также основанием летучей щелочи (аммиака), как это было незадолго до этого установлено Бертолле. Поэтому название радикал, или основание селитряной кислоты, не отражает основных химических свойств азота. Не лучше ли остановиться на слове азот, которое, по мнению членов номенклатурной комиссии, отражает основное свойство элемента — его непригодность для дыхания и жизни. Авторы химической номенклатуры предложили производить слово азот от греческой отрицательной приставки «а» и слова жизнь. Таким образом, название азот, по их мнению, отражало его нежизненность, или безжизненность.
Однако слово азот придумано не Лавуазье и не его коллегами по комиссии. Оно известно с древности и употреблялось философами и алхимиками средневековья для обозначения «первичной материи (основы) металлов», так называемого меркурия философов, или двойного меркурия алхимиков. Слово азот вошло в литературу, вероятно, в первые столетия средневековья, как и многие другие зашифрованные и имевшие мистический смысл названия. Оно встречается в сочинениях многих алхимиков, начиная с Бэкона (ХIII в.),- у Парацельса, Либавия, Валентина и др. Либавий указывает даже, что слово азот (azoth) происходит от старинного испано-арабского слова азок (azoque или azoc), обозначавшего ртуть. Но более вероятно, что эти слова появились в результате искажений переписчиками коренного слова азот (azot или azoth). Теперь происхождение слова азот установлено более точно. Древние философы и алхимики считали «первичную материю металлов» альфой и омегой всего существующего. В свою очередь это выражение заимствовано из Апокалипсиса — последней книги Библии: «я — альфа и омега, начало и конец, первый и последний». В древности и в средние века христианские философы считали приличным употреблять при написании своих трактатов только три языка, признававшихся «священными», — латинский, греческий и древнееврейский (надпись на кресте при распятии риста по евангельскому рассказу была сделана на этих трех языках). Для образования слова азот были взяты начальные и конечные буквы алфавитов этих трех языков (а, альфа, алеф и зэт, омега, тов — АААZОТ).
Составители новой химической номенклатуры 1787 г., и прежде всего инициатор ее создания Гитон де Морво, хорошо знали о существовании с древних времен слова азот. Морво отметил в «Методической энциклопедии» (1786) алхимическое значение этого термина. После опубликования «Метода химической номенклатуры» противники кислородной теории — флогистики — выступили с резкой критикой новой номенклатуры. Особенно, как отмечает сам Лавуазье в своем учебнике химии, критиковалось принятие «древних наименований». В частности, Ламетри -- издатель журнала «Observations sur la Physique» — оплота противников кислородной теории, указывал на то, что слово азот употреблялось алхимиками в другом смысле.
Несмотря на это, новое название было принято во Франции, а также и в России, заменив собою ранее принятые названия «флогистированный газ», «мофетт», «основание мофетта» и т. д.
Словообразование азот от греческого тоже вызвало справедливые замечания. Д. Н. Прянишников в своей книге «Азот в жизни растений и в земледелии СССР» (1945) совершенно правильно заметил, что словообразование от греческого «вызывает сомнения». Очевидно, эти сомнения имелись и у современников Лавуазье. Сам Лавуазье в своем учебнике химии (1789) употребляет слово азот наряду с названием «радикал нитрик» (radical nitrique).
Интересно отметить, что более поздние авторы, пытаясь, видимо, как-то оправдать неточность, допущенную членами номенклатурной комиссии, производили слово азот от греческого — дающий жизнь, животворный, создав искусственное слово «азотикос», отсутствующее в греческом языке (Диргарт, Реми и др.). Одиако этот путь образования слова азот едва ли может быть признан правильным, так как производное слово для названия азот должно было бы звучать «азотикон».
Неудачность названия азот была очевидной для многих современников Лавуазье, вполне сочувствовавших его кислородной теории. Так, Шапталь в своем учебнике химии «Элементы химии» (1790) предложил заменить слово азот словом нитроген (нитрожен) и называл газ, соответственно воззрениям своего времени (каждая молекула газа представлялась окруженной атмосферой теплорода), «газ нитрожен» (Gas nitrogene). Свое предложение Шапталь подробно мотивировал. Одним из доводов послужило указание, что название, означающее безжизненный, могло бы с большими основаниями быть дано другим простым телам (обладающим, например, сильными ядовитыми свойствами).
Название нитроген, принятое в Англии и в Америке, стало в дальнейшем основой международного названия элемента (Nitrogenium) и символа азота — N. Во Франции в начале Х1Х в. вместо символа -N употребляли символ Az. В 1800 г. один из соавторов химической номенклатуры — Фуркруа предложил еще одно название — алкалиген (алкалижен — alcaligene), исходя из того, что азот является «основанием» летучей щелочи (Alcali volatil) аммиака. Но это название не было принято химиками. Упомянем, наконец, название азота, которое употребляли химики-флогистики и, в частности Пристлей, в конце ХVIII в.- септон (Septon от французского Septique- гнилостный). Это название предложено, по-видимому, Митчелом — учеником Блэка, впоследствии работавшим в Америке. Дэви отверг это название. В Германии с конца ХVIII в. и до настоящего времени азот называют Stickstoff, что означает «удушливое вещество».
Что касается старых русских названий азота, фигурировавших в разнообразных сочинениях конца XVIII — начала ХIХ в., то они таковы: удушливый гас, нечистый гас; мофетический воздух (все это переводы французского названия Gas mofette), удушливое вещество (перевод немецкого Stickstoff), флогистированный воздух, гас огорюченный, огорюченный воздух (флогистические названия — перевод термина, предложенного Пристлеем -- Рlogisticated air). Употреблялись также названия; испорченный воздух (перевод термина Шееле Verdorbene Luft), селитротвор, селитротворный гас, нитроген (перевод названия, предложенного Шапталем — Nitrogene), алкалиген, щелочетвор (термины Фуркруа, переведенные на русский язык в 1799 и 1812 гг.), септон, гнилотвор (Septon) и др. Наряду с этими многочисленными названиями употреблялись и слова азот и азотический гас, особенно с начала ХIХ в.
В.Севергин в своем «Руководстве к удобнейшему разумению химических книг иностранных» (1815) объясняет слово азот следующим образом: «Azoticum, Azotum, Azotozum — азот, удушливое вещество»; «Azote — Азот, селитротвор»; «селитротворный газ, азотовый газ». Окончательно слово азот вошло в русскую химическую номенклатуру и вытеснило все другие названия после выхода в свет «Оснований чистой химии» Г. Гесса (1831).
Производные названия соединений, содержащих азот, образованы на русском и других языках либо от слова азот (азотная кислота, азосоединения и др.), либо от международного названия нитрогениум (нитраты, нитросоединения и др.). Последний термин происходит от древних названий нитр, нитрум, нитрон, обозначавших обычно селитру, иногда — природную соду. В словаре Руланда (1612) сказано: «Нитрум, борах (baurach), селитра (Sal petrosum), нитрум, у немцев — Salpeter, Вегgsalz — то же, что и Sal реtrae».
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | ---- | VIIIB | ---- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |


