Неон
| Неон | |
|---|---|
| Атомный номер | 10 |
| Внешний вид простого вещества | инертный газ без цвета, вкуса и запаха |
| Свойства атома | |
|
Атомная масса (молярная масса) |
20,1797 а. е. м. (г/моль) |
| Радиус атома | ? (38) пм |
|
Энергия ионизации (первый электрон) |
2079,4(21,55) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p6 |
| Химические свойства | |
| Ковалентный радиус | 58 пм |
| Радиус иона | 112 пм |
|
Электроотрицательность (по Полингу) |
0,0 |
| Электродный потенциал | 0 |
| Степени окисления | n/a |
| Термодинамические свойства простого вещества | |
| Плотность | ( при −246 °C)1,204 г/см³ |
| Молярная теплоёмкость | 20,79[2] Дж/(K·моль) |
| Теплопроводность | (0,0493) Вт/(м·K) |
| Температура плавления | 24,55 K |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 27,1 K |
| Теплота испарения | 1,74 кДж/моль |
| Молярный объём | 16,8 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированная |
| Параметры решётки | 4,430 Å |
| Отношение c/a | — |
| Температура Дебая | 63,00 K |
| Ne | 10 |
| 20,1797 | |
| [He]2s22p6 | |
| Неон | |
Неон — элемент главной подгруппы восьмой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 10. Обозначается символом Ne (Neon). Пятый по распространённости элемент во Вселенной (после водорода, гелия, кислорода и углерода). Простое вещество неон (CAS-номер: 7440-01-9) — инертный одноатомный газ без цвета, вкуса и запаха.
Происхождение названия
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Распространение
Земная кора
Из всех элементов второго периода неон — самый малочисленный на Земле. В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем его находится на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82·10−3% по объему, а его общие запасы оцениваются в 7,8·1014 м³. В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объеме воздуха содержится только 5,2 см³ гелия). Среднее содержание неона в земной коре мало − 7·10−9% по массе. Всего на нашей планете около 6,6·1010 т неона. В изверженных породах находится около 109 т этого элемента. По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете.
Определение
Качественно неон определяют по спектрам испускания (характеристические линии 585,25 нм и 540,05 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа.
Физические свойства
- Благородные газы — бесцветные одноатомные газы без цвета и запаха.
- Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности неон огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
- Насыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
Химические свойства
Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Изотопы неона
Существует три стабильных изотопа неона: 20Ne (изотопная распространённость 90,48 %), 21Ne (0,27 %) и 22Ne (9,25 %)[10]. Повсеместно преобладает легкий 20Ne.
Во многих альфа-активных минералах относительное содержание тяжелых 21Ne и 22Ne в десятки и сотни раз больше содержания их в воздухе. Это вызвано тем, что основными механизмами образования этих изотопов являются ядерные реакции, происходящие при бомбардировке ядер алюминия, натрия, магния и кремния продуктами распада ядер тяжёлых элементов. Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения.
Зафиксирован также ряд малопродуктивных ядерных реакций, при которых образуются 21Ne и 22Ne — это захват альфа-частиц ядрами тяжелого кислорода 18О и фтора 19F:
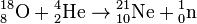

Источник преобладающего на Земле лёгкого нуклида 20Ne до сих пор не установлен.
Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20Ne. В метеоритах обнаруживают немало 21Ne и 22Ne, но эти нуклиды предположительно образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Кроме трех стабильных нуклидов неона, существует еще шестнадцать нестабильных.
Получение
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха. Разделение гелия и неона осуществляется за счет адсорбции и конденсации. Адсорбционный метод основан на способности неона в отличие от гелия адсорбироваться активированным углем, охлаждаемым жидким азотом. Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом.
Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха. Газообразные неон и гелий скапливаются в верхней части колонны высокого давления, то есть в конденсаторе-испарителе, откуда под давлением около 0.55 МПа подаются в трубное пространство дефлегматора, охлаждаемое жидким N2. Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N2 в адсорберы с активированным углем, из которых после нагревания поступает в газгольдер (содержание Ne + He до 70 %); степень извлечения смеси газов 0.5-0.6. Последнюю очистку от N2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при температуре жидкого N2, либо конденсационными методами — с помощью жидких Н2 или Ne. При использовании жидкого водорода дополнительно проводят очистку от примеси водорода с помощью CuO при 700 °С. В результате получают неон 99,9%-ной чистоты по объему.
Применение
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном.
Неоном наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители.
Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер).
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе.
Неоновые лампы используют для сигнальных целей на маяках и аэродромах, так как их красный цвет очень мало рассеивается туманом и мглой.
Биологическая роль
Неон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытах не регистрируется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома высокого давления» (НСВД).
В связи с этим, наряду с гелием, неон в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Содержание неона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии.
Интересные факты
«Неоновые огни» оправдывают своё название только в случае свечения красного цвета. Для получения других цветов используют ртуть и фосфор в определённых пропорциях или другие благородные газы.
Неон, Neon, Nе (10)
Химический элемент неон был открыт Рамзаем и Траверсом в 1898 г., через несколько дней после открытия криптона. Ученые отобрали первые пузырьки газа, образующегося при испарении жидкого аргона, и установили, что спектр этого газа указывает на присутствие нового элемента. Рамзай так рассказывает о выборе названия для этого элемента: «Когда мы впервый раз рассматривали его спектр, при этом находился мой 12-летний сын.»
Отец, — сказал он — как называется этот красивый газ?
Это еще не решено — ответил я.
Он новый? — полюбопытствовал сын.
Новооткрытый — возразил я.
Почему бы в таком случае не назвать его Novum, отец?
Это не подходит, потому что novum не греческое слово — ответил я.
Мы назовем его неоном, что по гречески значит новый, таким то образом газ получил свое название.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | ---- | VIIIB | ---- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |




