Бериллий
| Бериллий | |
|---|---|
| Атомный номер | 4 |
| Внешний вид простого вещества |

мягкий металл серебристо-белого цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
9,01218 а.е.м. (г/моль) |
| Радиус атома | 112 пм |
|
Энергия ионизации (первый электрон) |
898,8 (9,32) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 |
| Химические свойства | |
| Ковалентный радиус | 90 пм |
| Радиус иона | 35 (+2e) пм |
|
Электроотрицательность (по Полингу) |
1.57 |
| Электродный потенциал | −1,69 В |
| Степени окисления | 2; 1 |
| Термодинамические свойства простого вещества | |
| Плотность | 1,848 г/см³ |
| Молярная теплоёмкость | 16,44 Дж/(K·моль) |
| Теплопроводность | 201 Вт/(м·K) |
| Температура плавления | 1551 K |
| Теплота плавления | 12,21 кДж/моль |
| Температура кипения | 3243 K |
| Теплота испарения | 309 кДж/моль |
| Молярный объём | 5,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,286; c=3,584 Å |
| Отношение c/a | 1,567 |
| Температура Дебая | 1000 K |
| Be | 4 |
| 9,012182 | |
| [He]2s2 | |
| Бериллий | |
Бериллий химический элемент главной подгруппы второй группы, второго периода периодической системы химических элементов Д.И.Менделеева, с атомным номером 4. Обозначается символом Be (Beryllium). Простое вещество бериллий (CAS-номер: 7440-41-7)— мягкий высокотоксичный металл серого цвета, имеет весьма высокую стоимость.
История
Открыт в 1798г. французским химиком Луи Никола Вокленом. Большую работу по установлению состава соединений бериллия и его минералов провёл русский химик И.В.Авдеев (1818—1865). Именно он доказал, что оксид бериллия имеет состав BeO, а не Be2O3, как считалось ранее.
Происхождение названия

Определение элемента бериллий произошло от названия минерала берилла (beryllos) (силикат бериллия и алюминия, Be3Al2Si6O18), которое восходит к названию города Белур (Веллуру) в Южной Индии, недалеко от Мадраса; с древних времён в Индии были известны месторождения изумрудов— разновидности берилла. Из-за сладкого вкуса растворимых в воде соединений бериллия элемент вначале называли «глюциний» (от греч. glykys— сладкий).
Нахождение в природе
Изотоп 8Be отсутствует в природе, поскольку является крайне нестабильным и имеет период полураспада 10−18 с. Стабильным является 9Be. Кроме 9Be в природе встречаются радиоактивные изотопы 7Be и 10Be.
Содержание бериллия в земной коре— около 3,5 г/т, обычно он встречается как примесь к различным минералам. Известно более 30 собственно бериллиевых минералов, но только 6 из них считаются более-менее распространёнными: берилл, хризоберилл, бертрандит, фенакит, гельвин, даналит. Промышленное значение имеет в основном берилл, в РФ (Республика Бурятия) разрабатывается фенакит-бертрандитовое Ермаковское месторождение.
Разновидности берилла считаются драгоценными камнями: аквамарин — голубой, зеленовато-голубой, голубовато-зеленый; изумруд— густо-зеленый, ярко-зеленый; гелиодор — желтый; известны ряд других разновидностей берилла, различающихся окраской (темно-синие, розовые, красные, бледно-голубые, бесцветные и др.). Цвет бериллу придают примеси различных элементов.
Физические свойства
Бериллий— мягкий, но не пластичный (легко разрушается) металл серебристо-белого цвета. Имеет высокий (в связи с чем ему ошибочно приписывается высокая твёрдость) модуль упругости— 300 ГПа (у сталей— 200—210 ГПа). На воздухе активно покрывается стойкой оксидной плёнкой BeO.
Модуль продольной упругости (модуль Юнга) 300 ГПа (312кгс/мм2). Механические свойства Бериллия зависят от чистоты металла, величины зерна и текстуры, определяемой характером обработки. Предел прочности Бериллия при растяжении 200—550 Мн/м2(20-55 кгс/мм2), удлинение 0,2-2%, что при таком высоком модуле упругости обеспечивает его хрупкость. Обработка давлением приводит к определенной ориентации кристаллов. Возникает анизотропия, становится возможным значительное улучшение свойств. Предел прочности в направлении вытяжки доходит до 400—800 Мн/м2(40-80 кгс/мм2), предел текучести 250—600 Мн/м2(25-60 кгс/мм2), а относительное удлинение до 4-12%. Механические свойства в направлении, перпендикулярном вытяжке, почти не меняются. Бериллий— хрупкий металл; его ударная вязкость 10-50 кДж/м2 (0,1-0,5 кгс·м/см2). Температура перехода Бериллия из хрупкого состояния в пластическое 200—400°C.
Химические свойства
Получение
В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид бериллия:
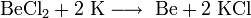
В настоящее время бериллий получают, восстанавливая его фторид магнием:
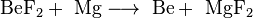 ,
,
либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды.
Применение Бериллия
Легирование сплавов
Бериллий в основном используют как легирующую добавку к различным сплавам. Добавка бериллия значительно повышает твёрдость и прочность сплавов, коррозионную устойчивость поверхностей изготовленных из этих сплавов изделий. В технике довольно широко распространены бериллиевые бронзы типа BeB (пружинные контакты). Добавка 0,5% бериллия в сталь позволяет изготовить пружины, которые пружинят при красном калении.
Рентгенотехника
Бериллий слабо поглощает рентгеновское излучение, поэтому из него изготавливают окошки рентгеновских трубок (через которые излучение выходит наружу).
Ядерная энергетика
В атомных реакторах из бериллия изготовляют отражатели нейтронов, его используют как замедлитель нейтронов. В смесях с некоторыми α-радиоактивными нуклидами бериллий используют в ампульных нейтронных источниках, так как при взаимодействии ядер бериллия-9 и α-частиц возникают нейтроны: 9Ве + α → n + 12C. Оксид бериллия является наиболее теплопроводным из всех оксидов и служит высокотеплопроводным высокотемпературным изолятором, и огнеупорным материалом(тигли), а кроме того наряду с металлическим бериллием служит в атомной технике как более эффективный замедлитель и отражатель нейтронов чем чистый бериллий, кроме того оксид бериллия в смеси с окисью урана применяется в качестве очень эффективного ядерного топлива. Фторид бериллия в сплаве с фторидом лития применяется в качестве теплоносителя и растворителя солей урана, плутония, тория в высокотемпературных жидкосолевых атомных реакторах.
Фторид бериллия используется в атомной технике для варки стекла применяемого для регулирования небольших потоков нейтронов. Самый технологичный и качественный состав такого стекла -(BeF2−60%,PuF4−4%,AlF3−10%, MgF2−10%, CaF2−16%). Этот состав наглядно показывает один из примеров применения соединений плутония в качестве конструкционного материала (частичное).
Лазерные материалы
В лазерной технике находит применение алюминат бериллия для изготовления твердотельных излучателей (стержней, пластин).
Аэрокосмическая техника
В производстве тормозов для аэрокосмической техники, тепловых экранов и систем наведения с бериллием не может конкурировать практически ни один конструкционный материал. Конструкционные материалы на основе бериллия обладают одновременно и лёгкостью, и прочностью, и стойкостью к высоким температурам. Будучи в 1,5 раз легче алюминия, эти сплавы в то же время прочнее многих специальных сталей. Налажено производство бериллидов применяемых как конструкционные материалы для двигателей и обшивки ракет и самолетов, а так же в атомной технике.
Ракетное топливо
Стоит отметить высокую токсичность и высокую стоимость металлического бериллия, и в этой связи приложены значительные усилия для выявления бериллийсодержащих топлив имеющих значительно меньшую общую токсичность и стоимость. Одним из таких соединений бериллия является гидрид бериллия.
Огнеупорные материалы
Оксид бериллия применяется в качестве очень важного огнеупорного материала в специальных случаях. Считается одним из лучших огнеупорных материалов и при этом это самый теплопроводный огнеупорный материал.
Биологическая роль и физиологическое действие
В живых организмах бериллий не несёт какой-либо значимой биологической функции. Однако бериллий может замещать магний в некоторых ферментах, что приводит к нарушению их работы. Нормальное содержание бериллия в организме взрослого человека (при массе тела 60 кг) составляет 0,031мг, ежедневное поступление с пищей— около 0,01мг.
Бериллий— ядовит: Летучие (и растворимые) соединения бериллия, в том числе и пыль, содержащая соединения бериллия, высокотоксичны. Для воздуха ПДК (предельно допустимые концентрации) вещества в пересчёте на бериллий составляет 0,001 мг/м³. Бериллий обладает ярко выраженным аллергическим и канцерогенным действием. Вдыхание атмосферного воздуха содержащего бериллий приводит к тяжёлому заболеванию органов дыхания — бериллиозу.
Дополнительная информация по Бериллию
Соединения бериллия
Бериллий, Beryllium, Be (4)
Содержащие бериллий минералы (драгоценные камни) — берилл, смарагд, изумруд, аквамарин и др.- известны с глубокой древности. Некоторые из них добывались на Синайском полуострове еще в XVII в. до н. э. В Стокгольмском папирусе (III в.) описываются способы изготовления поддельных камней. Название берилл встречается у греческих и латинских (Beryll) античных писателей и в древнерусских произведениях, например в «Изборнике Святослава» 1073 г., где берилл фигурирует под названием вируллион. Исследование химического состава драгоценных минералов этой группы началось, однако, лишь в конце XVIII в. с наступлением химико-аналитического периода.
Первые анализы (Клапрот, Биндгейм и др.) не обнаружили в берилле ничего особенного.
В конце XVIII в. известный минералог аббат Гаюи обратил внимание на полное сходство кристаллического строения берилла из Лиможа и смарагда из Перу. Вокелен произвел химический анализ обоих минералов (1797) и обнаружил в обоих новую землю, отличную от алюмины. Получив соли новой земли, он установил, что некоторые из них обладают сладким вкусом, почему и назвал новую землю глюцина (Glucina) от греческого — сладкий. Новый элемент, содержащийся в этой земле, был назван соответственно глюцинием (Glucinium). Это название употреблялось во Франции в XIX в., существовал даже символ -- Gl.
Клапрот, будучи противником наменования новых элементов по случайным свойствам их соединений, предложил именовать глюциний бериллием (Beryllium), указав, что сладким вкусом обладают соединения и других элементов. Металлический бериллий был впервые получен Велером и Бусси в 1728 г. путем восстановления хлорида бериллия металлическим калием. Отметим здесь выдающиеся исследования русского химика И.В.Авдеева по атомному весу и составу окисла бериллия (1842). Авдеев установил атомный вес бериллия 9,26 (совр.9,0122), тогда как Берцелиус принимал его равным 13,5, и правильную формулу окисла.
О происхождении названия минерала берилл, от которого образовано слово бериллий, существует несколько версий. А. М. Васильев (по Диргарту) приводит следующее мнение филологов: латинское и греческое названия берилла могут быть сопоставлены с практритским veluriya и санскритским vaidurya. Последнее является названием некоторого камня и происходит от слова vidura (очень далеко), что, по-видимому, означает какую-то страну или гору. Мюллер предложил другое объяснение: Vaidurya произошло от первоначального vaidarya или vaidalya, а последнее от vidala (кошка). Иначе говоря, vaidurya означает приблизительно «кошачий глаз». Рай указывает, что в санскрите топаз, сапфир и коралл считались кошачьим глазом. Третье объяснение дает Липпман, который считает, что слово берилл обозначало какую-то северную страну (откуда поступали драгоценные камни) или народ. В другом месте Липпман отмечает, что Николай Кузанский писал, что немецкое Brille (очки) происходит от варварско-латинского berillus. Наконец, Лемери, объясняя слово берилл (Beryllus), указывает, что Berillus, или Verillus, означает «мужской камень».
В русской химической литературе начала XIX в. глюцина называлась — сладимая земля, сладозем (Севергин, 1815), сладкозем (Захаров, 1810), глуцина, глицина, основание глицинной земли, а элемент именовался глицинием, глицинитом, глицием, сладимцем и пр. Гизе предложил название бериллий (1814). Гесс, однако,придерживался названия глиций; его употреблял в качестве синонима и Менделеев (1-е изд. «Основ химии»).
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | ---- | VIIIB | ---- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |


