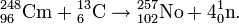Нобелий
| Нобелий | |
|---|---|
| Атомный номер | 102 |
| Внешний вид простого вещества |
Радиоактивный искусственно получаемый металл |
| Свойства атома | |
|
Атомная масса (молярная масса) |
259,1009 а. е. м. (г/моль) |
| Радиус атома | 285 пм |
|
Энергия ионизации (первый электрон) |
640(6,63) кДж/моль (эВ) |
| Электронная конфигурация | [Rn] 5f14 7s2 |
| Химические свойства | |
| Ковалентный радиус | n/a пм |
| Радиус иона | n/a пм |
|
Электроотрицательность (по Полингу) |
1,3 |
| Электродный потенциал |
No←No3+ -1,2В No←No2+ -2,5В |
| Степени окисления | 3, 2 |
| Термодинамические свойства простого вещества | |
| Плотность | n/a г/см³ |
| Молярная теплоёмкость | n/a Дж/(K·моль) |
| Теплопроводность | n/a Вт/(м·K) |
| Температура плавления | 1100 K |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | n/a K |
| Теплота испарения | n/a кДж/моль |
| Молярный объём | n/a см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | |
| Параметры решётки | n/a Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| No | 102 |
| 259,1009 | |
| 5f147s2 | |
| Нобелий | |
Нобелий (No Nobelium) — искусственно полученный химический элемент группы актиноидов с атомным номером 102. Имеет несколько нестабильных изотопов, самый долгоживущий из которых 259No имеет период полураспада 58 минут.
История открытия и происхождение названия
Первыми об открытии 102 элемента заявила в 1957 году группа учёных, работавших в Стокгольме (Швеция). Они же и предложили назвать элемент нобелий в честь Альфреда Нобеля. Однако позже эти данные не были подтверждены работами других лабораторий. 102 элемент был впервые получен в ходе экспериментов на ускорителе Объединённого института ядерных исследований в Дубне в 1963 году—1967 годах группой Г. Н. Флёрова. Независимо от них примерно в то же время элемент был получен и в Калифорнийском университете в г.Беркли (США). В 1992 году международное научное сообщество признало открытие 102 элемента за физиками Дубны.
Советские исследователи предложили назвать новый элемент жолиотий (Jl) в честь Фредерика Жолио-Кюри, а американцы дали ему имя нобелий (No). Оба этих названия (Jl и No) имели хождение в изданных в разные годы Периодических таблицах элементов, пока, согласно решению ИЮПАК, за 102 элементом не было закреплено название нобелий.
Получение
В разное время различные изотопы нобелия были получены на циклотронах в результате бомбардировки мишеней из тяжелых элементов лёгкими ионами. В качестве мишени могут использоваться изотопы урана, ряда трансурановых элементов (америций, кюрий, эйнштейний, плутоний, калифорний) или свинца. Для бомбардировки мишени берутся ионы неона 22Ne, кислорода 18O, углерода 12С, кальция48Ca и некоторые другие. Ниже приведён пример одной ядерной реакции, приводящей к образованию изотопа 257No:
Заметим, что каждый из изотопов может быть получен несколькими комбинациями пар мишень-частица.
Изотопы
Описано семнадцать изотопов нобелия с массовыми числами от 248 до 264 Изотопы нобелия. Два из них, 261No и 263No, до сих пор не были получены. Стабильных изотопов элемент не имеет. Наибольший период полураспада имеет изотоп 259No (58 минут), наименьший — 248No (меньше 2 микросекунд).
Свойства
Малое время жизни изотопов нобелия и ничтожно малое количество получаемых атомов (всего порядка сотни штук) не позволяют надёжно измерить большинство его физических и химических свойств. Вероятно, как и большинство металлов, нобелий имеет серый цвет и металлический блеск. Иногда приводится его температура плавления 827 °С, но её всё же нельзя считать достоверно установленной. Нобелий может иметь две степени окисления +2 и +3, и по химическим свойствам близок к своему аналогу из группы лантаноидов, иттербию.
Химиками Дубны методом фронтальной газовой хроматографии было установлено, что нобелий образует нелетучий хлорид, а американские химики обнаружили, что в водных растворах устойчива степень окисления +2
Применение
Ввиду крайне малого времени жизни его изотопов, на сегодняшний день нобелий практического применения не нашёл.
Биологическая роль
Нобелий невозможно получить в каких-либо заметных количествах, поэтому его биологическая роль в настоящее время не изучена.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | ---- | VIIIB | ---- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |