Медь
|
Медь |
|
|---|---|
| Атомный номер |
29 |
| Внешний вид простого вещества |
пластичный металл золотисто-розового цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
|
| Радиус атома |
128 пм |
|
Энергия ионизации (первый электрон) |
|
| Электронная конфигурация |
[Ar] 3d10 4s1 |
| Химические свойства | |
| Ковалентный радиус |
117 пм |
| Радиус иона |
(+2e) 72 (+1e) 96 пм |
|
Электроотрицательность (по Полингу) |
1,90 |
| Электродный потенциал |
+0,337 В/ +0,521 В |
| Степени окисления |
2, 1 |
| Термодинамические свойства простого вещества | |
| Плотность | |
| Молярная теплоёмкость | |
| Теплопроводность | |
| Температура плавления |
1356,6 K |
| Теплота плавления | |
| Температура кипения |
2840 K |
| Теплота испарения | |
| Молярный объём | |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Параметры решётки |
3,615 Å |
| Отношение c/a | — |
| Температура Дебая |
315 K |
| Cu | 29 |
| 63,546 | |
| 3d104s1 | |
| Медь | |
Медь —элемент побочной подгруппы первой группы, четвертого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной пленки). C давних пор широко применяется человеком. История и происхождение названия
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век). Латинское название элемента происходит от названия острова Кипр (лат. Cuprum), на котором добывали медь.
Нахождение в природе
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде. Самый большой самородок был найден в Северной Америке, а его вес составлял 420 тонн [2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
На воздухе покрывается оксидной плёнкой.
Соединения
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu2O имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн.) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]- устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl-(водн.) → [CuCl]- (водн.)
Хлорид меди(I) — белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)
Образует неустойчивый комплекс с CO
CuCl+CO → Cu(CO)Cl разлагающийся при нагревании
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]-. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4].
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
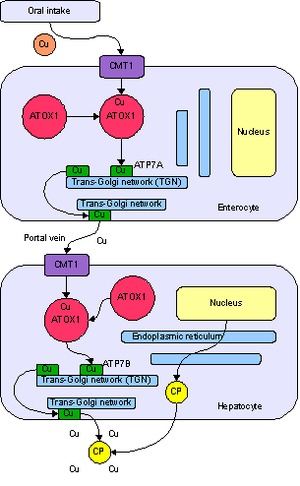
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[5]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей.[источник не указан 226 дней]
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[6] (агентство подчеркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и ее сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/H1N1 (т. н. «свиной грипп»)
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т.. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
Мировое производство меди в 2007 году составляло15,4 млн т, а в 2008 году — 15,7 млн т. Лидерами производства были: Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.), США (1,170/1,310), Перу (1,190/1,220), Китай (0,946/1,000), Австралия (0,870/0,850), Россия (0,740/0,750), Индонезия (0,797/0,650), Канада (0,589/0,590), Замбия (0,520/0,560), Казахстан (0,407/0,460), Польша (0,452/0,430), Мексика (0,347/0,270).
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причем, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Однажды нашли самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
- 2CO + (CuOH)2CO2 (t°) → 3CO2 + 2Cu + H2O.
Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н. э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | ---- | VIIIB | ---- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |