Золото
| Золото | |
|---|---|
| Атомный номер | 79 |
| Внешний вид простого вещества |
Мягкий ковкий жёлтый металл |
| Свойства атома | |
|
Атомная масса (молярная масса) |
196,96654 а. е. м. (г/моль) |
| Радиус атома | 146 пм |
|
Энергия ионизации (первый электрон) |
889,3 (9,22) кДж/моль (эВ) |
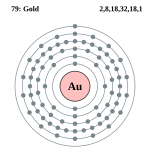
| Электронная конфигурация | [Xe] 4f14 5d10 6s1 |
| Химические свойства | |
| Ковалентный радиус | 134 пм |
| Радиус иона | (+3e) 85 (+1e) 137 пм |
|
Электроотрицательность (по Полингу) |
2,54 |
| Электродный потенциал |
Au←Au-3 1,50 В Au←Au+ 1,70В |
| Степени окисления | -3, 1 |
| Термодинамические свойства простого вещества | |
| Плотность | 19,3 г/см³ |
| Молярная теплоёмкость | 25,39[1] Дж/(K·моль) |
| Теплопроводность | 318 Вт/(м·K) |
| Температура плавления | 1337,58 K |
| Теплота плавления | 12,68 кДж/моль |
| Температура кипения | 3080 K |
| Теплота испарения | ~340 кДж/моль |
| Молярный объём | 10,2 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Параметры решётки | 4,080 Å |
| Отношение c/a | n/a |
| Температура Дебая | 170,00 K |
| Au | 79 |
| 196,96654 | |
| [Xe]4f145d106s1 | |
| Золото | |
Золото — элемент побочной подгруппы первой группы, шестого периода периодической системы химических элементов, с атомным номером 79. Обозначается символом Au (лат. Aurum). Простое вещество золото (CAS-номер: 7440-57-5) — благородный металл жёлтого цвета.
Праславянское *zolto (русск. золото, укр. золото, ст.-слав. злато, польск. złoto) родственно лит. geltonas «жёлтый», латыш. zelts «золото, золотой»; с другим вокализмом: готск. gulþ, нем. Gold, англ. gold; далее санскр. hiraṇyam, авест. zaranya «золото», также санскр. hari «жёлтый, золотистый, зеленоватый», от праиндоевропейского корня *ǵʰel- «жёлтый, зелёный, яркий». Отсюда же названия цветов: жёлтый, зелёный.
Связь с корнем «солнце» (sol, др.-греч. ἥλιος) сомнительна.
Свойства золота
Физические свойства
Чистое золото — мягкий металл жёлтого цвета. Красноватый оттенок некоторым изделиям из золота, например, монетам, придают примеси других металлов, в частности меди. В тонких плёнках золото просвечивает зелёным. Золото обладает исключительно высокой теплопроводностью и низким электрическим сопротивлением. Золото — очень тяжёлый металл: шар из чистого золота диаметром 46 мм имеет массу 1 кг. Литровая бутыль, заполненная золотым песком, весит приблизительно16 кг.
Тяжесть золота — плюс для его добычи. Самые простые технологические процессы, такие, как, например, промывка на шлюзах, могут обеспечить весьма высокую степень извлечения золота из промываемой породы.
Золото очень ковко и тягуче. Из кусочка золота массой в один грамм можно вытянуть проволоку длиной в три километра или изготовить золотую фольгу в 500 раз тоньше человеческого волоса (0,0001 мм). Через такой листочек фольги луч света просвечивает зеленоватым цветом. Мягкость чистого золота настолько велика, что его можно царапать ногтем. Поэтому в ювелирных изделиях золото всегда сплавляется с медью или серебром. Состав таких сплавов выражается пробой, которая указывает число весовых частей золота в 1000 частей сплава(в российской практике). Проба химически чистого золота соответствует 999.9 пробе — его ещё называют «банковским» золотом, так как из такого золота изготавливают слитки.
Химические свойства
Золото — самый инертный металл, стоящий в ряду напряжений правее всех других металлов, при нормальных условиях оно не взаимодействует с большинством кислот и не образует оксидов, благодаря чему было отнесено к благородным металлам, в отличие от металлов обычных, легко разрушающихся под действием окружающей среды. Затем была открыта способность царской водки растворять золото, что поколебало уверенность в его инертности.
Наиболее устойчивая степень окисления золота в соединениях +3, в этой степени окисления оно легко образует с однозарядными анионами (F−, Cl−. CN−) устойчивые плоские квадратные комплексы [AuX4]−. Относительно устойчивы также соединения со степенью окисления +1, дающие линейные комплексы [AuX2]−. Долгое время считалось, что +3 — высшая из возможных степеней окисления золота, однако, используя дифторид криптона, удалось получить соединения Au+5 (фторид AuF5, соли комплекса [AuF6]−). Соединения золота(V) стабильны лишь со фтором и являются сильнейшими окислителями.
Степень окисления +2 для золота нехарактерна, в веществах, в которых она формально равна 2, половина золота, как правило, окислена до +1, а половина — до +3, например, правильной ионной формулой сульфата золота(II) AuSO4 будет не Au2+(SO4)2−, а Au1+Au3+(SO4)2−2. Недавно обнаружены комплексы в которых золото все-таки имеет степень окисления +2.
Из чистых кислот золото растворяется только в горячей концентрированной селеновой кислоте:
- 2Au + 6H2SeO4 = Au2(SeO4)3 + 3H2SeO3 + 3H2O
Золото сравнительно легко реагирует с кислородом и другими окислителями при участии комплексобразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты:
- 4Au + 8CN− + 2H2O + O2 → 4[Au(CN)2]− + 4 OH−
В случае реакции с хлором возможность комплексообразования также значительно облегчает ход реакции: если с сухим хлором золото реагирует при ~200 °C с образованием хлорида золота(III), то в концентрированном водном растворе соляной и азотной кислот (царская водка) золото растворяется с образованием хлораурат-иона уже при комнатной температуре:
- 2Au + 3Cl2 + 2Cl− → 2[AuCl4]−
Золото легко реагирует с жидким бромом и его растворами в воде и органических растворителях, давая трибромид AuBr3.
Со фтором золото реагирует в интервале температур 300−400°C, при более низких реакция не идёт, а при более высоких фториды золота разлагаются.
Золото также растворяется во ртути, фактически образуя легкоплавкий сплав (амальгаму).
Физиологическое воздействие
Некоторые соединения золота токсичны, накапливаются в почках, печени, селезёнке и гипоталамусе, что может привести к органическим заболеваниям и дерматитам, стоматитам, тромбоцитопении.
Геохимия золота
Содержание золота в земной коре очень низкое — 3 мкг/кг, но месторождения и участки, резко обогащённые металлом, весьма многочисленны. Золото содержится и в воде. 1 л и морской, и речной воды несёт примерно 4*10−9 г золота.
Для золота характерна самородная форма. Среди других его форм стоит отметить электрум, сплав золота с серебром, который обладает зеленоватым оттенком и относительно легко разрушается при переносе водой. В горных породах золото обычно рассеяно на атомарном уровне. В месторождениях оно зачастую заключено в сульфиды и арсениды.
Различаются первичные месторождения золота, россыпи, в которые оно попадает в результате разрушения рудных месторождений и месторождения с комплексными рудами, в которых золото извлекается в качестве попутного компонента.
Добыча золота
Люди добывают золото с незапамятных времён. С золотом человечество столкнулось уже в V тыс. до н. э. в эпоху неолита благодаря его распространению в самородном состоянии.
По предположению археологов, начало системной добычи было положено на Ближнем Востоке, откуда золотые украшения поставлялись, в частности, в Египет. Именно в Египте в гробнице королевы Зер и одной из королев Пу-аби Ур в Шумерской цивилизации были найдены первые золотые украшения, датируемые III тыс. до н. э.
В России принято считать началом золотодобычи 21 мая (1 июня) 1745 г., когда Ерофей Марков, нашедший золото на Урале, объявил о своем открытии в Канцелярии Главного правления заводов в Екатеринбурге.
За всю историю человечеством добыто около 140 тыс. т золота.
В 2007 году добыли 2 380 т золота, а в 2008 — 2 330 т. Лидерами добычи стали: Китай (добыл в 2007 году 275 т, а в 2008 г. — 295 т), ЮАР (252/250), США (238/230), Австралия (246/225), Перу (170/175), Россия (157/165), Канада (101/100), Индонезия (118/90), Узбекистан (85/85), Гана (84/84), Папуа — Новая Гвинея (65/65), Чили (42/42), Мексика (39/41), Бразилия (40/40).
В России существует около 16 золотодобывающих компаний. Лидером добычи золота в России является компания Полюс Золото на которую приходится около 20 % рынка. Наибольшее количество золота добывается в Чукотском АО, Красноярском крае и Амурской области. [3]
Разведанные мировые запасы золота оцениваются в 100 тыс. т.
Получение
Для получения золота используются его основные физические и химические свойства: присутствие в природе в самородном состоянии, способность реагировать лишь с немногими веществами (ртуть, цианиды). C развитием современных технологий более популярными становятся химические способы.
Промывка
Метод промывки основан на высокой плотности золота, благодаря которой в потоке воды, минералы с плотностью меньше золота (а это почти все минералы земной коры) смываются и металл концентрируется в тяжёлой фракции, песка состоящего из минералов повышенной плотности, который называется шлихом. Этот процесс называется отмывкой шлиха или шлихованием. В небольших объёмах её можно проводить вручную, при помощи промывочного лотка. Этот способ используется с древнейших времён, и до сих пор для отработки маленьких россыпных месторождений старателями, но основное его применение — поиск месторождений золота, алмазов и других ценных металлов.
Промывка используется для разработки крупных россыпных месторождений, но при этом применяются специальные технические устройства: драги и промывочные устройства. Полученные шлихи, кроме золота, содержат множество других плотных минералов и металл из них извлекается, например, путём амальгамации.
Методом промывки разрабатываются все россыпные месторождения золота, ограничено он применяется на коренных месторождениях. Для этого породу дробят и затем подвергают промывке. Этот метод не может быть применён на месторождениях с рассеянным золотом, где оно так распылено в породе, что после дробления не обособляется в отдельные зёрна и смывается при промывке вместе с другими минералами. К сожалению, при промывке теряется не только мелкое золото, которое легко смывается с промывочной колоды, но и крупные самородки, гидравлическая крупность которых не позволяет им спокойно оседать в ячейках коврика. Поэтому на драгах и на промприборах обязательно следят за крупными катящимися обломками — это вполне могут оказаться самородки!
Этот метод добычи золота исторически был первым, и он очень дёшев, потому что не требует строительства дорогих заводов, и в случае речных отложений не нужно дробить породу. Экономически рентабельна отработка россыпей с содержанием золота более 0,1 г на 1 кубический метр рыхлой породы (песков, суглинков и т. д.).
Амальгамация
Метод амальгамации основан на способности ртути образовывать сплавы — амальгамы с различными металлами, в том числе и с золотом. В этом методе увлажнённая дроблёная порода смешивалась со ртутью и подвергалась дополнительному измельчению в мельницах — бегунных чашах. Амальгаму золота (и сопутствующих металлов) извлекали из получившегося шлама промывкой, после чего ртуть отгонялась из собранной амальгамы и использовалась повторно. Метод амальгамации известен с I века до н. э., наибольшие масштабы приобрёл в американских колониях Испании начиная с XVI века: это стало возможным благодаря наличию в Испании огромного ртутного месторождения — Альмаден. В более позднее время использовался метод внешней амальгамации, когда дроблёная золотоносная порода при промывке пропускалась через обогатительные шлюзы, выстланные медными листами, покрытыми тонким слоем ртути. Метод амальгамации применим только на месторождениях с высоким содержанием золота или уже при его обогащении. Сейчас он используется очень редко, главным образом старателями в Африке и Южной Америке.
Цианирование
Золото растворяется в растворах синильной кислоты и её солей, и это его свойство дало начало ряду методов извлечения путем цианирования руд.
Метод цианирования основан на реакции золота с цианидами в присутствии кислорода воздуха: измельчённая золотоносная порода обрабатывается разбавленным (0,3-0,03 %) раствором цианида натрия, золото из образующегося раствора цианоаурата натрия Na[Au(CN)2] осаждается либо цинковой пылью, либо на специальных ионнообменых смолах.
Метод цианирования первоначально применялся на крупных заводах, где порода дробилась и цианирование проводилось в специальных чанах. Однако развитие технологии привело к появлению метода кучного выщелачивания, который заключается в следующем: готовится водонепроницаемая площадка, на неё насыпается руда и её орошают растворами цианидов, которые, просачиваясь через толщу породы, растворяют золото. После этого они поступают в специальные сорбционные колонны, в которых золото осаждается, а регенерированный раствор вновь отправляется на кучу.
Метод цианирования ограничен минеральным составом руд, он неприменим, если руда содержит большое количество сульфидов или арсенидов, так как цианиды реагируют с этими минералами. Поэтому цианированием перерабатываются малосульфидные руды или руды из зоны окисления, в которой сульфиды и арсениды окислены атмосферным кислородом.
Для извлечения золота из сульфидных руд используются сложные многоэтапные технологии. Золото, добытое из месторождений, содержит различные примеси, поэтому его подвергают специальным процессам высокой очистки, которые производятся на аффинажных заводах.
Регенерация
Осуществляется действием 10 % раствора щелочи на растворы солей золота с последующим осаждением аффинажного золота на алюминий из горячего раствора гидрооксида.
Применение
Имеющееся в настоящее время в мире золото распределено так: около 10 % — в промышленных изделиях, остальное делится приблизительно поровну между централизованными запасами (в основном, в виде стандартных слитков химически чистого золота), собственностью частных лиц в виде слитков и ювелирными изделиями.
Как объект инвестирования
Золото является важнейшим элементом мировой финансовой системы, поскольку данный металл не подвержен коррозии, имеет много сфер технического применения, а запасы его невелики. Золото практически не терялось в процессе исторических катаклизмов, а лишь накапливалось и переплавлялось. В настоящее время мировые банковские резервы золота оцениваются в 32 тыс. тонн (если сплавить все это золото воедино, получится куб со стороной всего лишь 12 м).
Золото издавна использовалось многими народами в качестве денег. Золотые монеты — самый хорошо сохраняющийся памятник старины. Однако как монопольный денежный товар оно утвердилось только к XIX веку. Вплоть до Первой мировой войны все мировые валюты были основаны на золотом стандарте (период 1870—1914 называют «золотым веком»). Бумажные купюры в это время выполняли роль удостоверений о наличии золота. Они свободно обменивались на золото.
В промышленности
По своей химической стойкости и механической прочности золото уступает большинству платиноидов, но незаменимо, как материал для электрических контактов. Поэтому в микроэлектронике золотые проводники и гальванические покрытия золотом контактных поверхностей, разъёмов, печатных плат используются очень широко.
Золото используется в качестве мишени в ядерных исследованиях, в качестве покрытия зеркал, работающих в дальнем инфракрасном диапазоне, в качестве специальной оболочки в нейтронной бомбе.
Золотые припои очень хорошо смачивают различные металлические поверхности и применяются при пайке металлов. Тонкие прокладки, изготовленные из мягких сплавов золота, используются в технике сверхвысокого вакуума.
Золочение металлов (в древности — исключительно амальгамный метод, в настоящее время — преимущественно гальваническое) широко используется в качестве метода защиты от коррозии. Хотя такое покрытие неблагородных металлов имеет существенные недостатки (мягкость покрытия, высокий потенциал при точечной коррозии), оно распространено также из-за того, что готовое изделие приобретает вид очень дорогого, «золотого».
Золото зарегистрировано в качестве пищевой добавки Е175.
В ювелирных изделиях

Традиционным и самым крупным потребителем золота является ювелирная промышленность. Ювелирные изделия изготавливают не из чистого золота, а из его сплавов с другими металлами, значительно превосходящими золото по механической прочности и стойкости. В настоящее время для этого служат сплавы Au-Ag-Cu, которые могут содержать добавки цинка, никеля, кобальта, палладия. Стойкость к коррозии таких сплавов определяются, в основном, содержанием в них золота, а цветовые оттенки и механические свойства — соотношением серебра и меди.
Важнейшей характеристикой ювелирных изделий является их проба, характеризующая содержание в них золота.
В стоматологии
Значительные количества золота потребляет стоматология: коронки и зубные протезы изготовляют из сплавов золота с серебром, медью, никелем, платиной, цинком. Такие сплавы сочетают коррозионную стойкость с высокими механическими свойствами.
В фармакологии
Соединения золота входят в состав некоторых медицинских препаратов, используемых для лечения ряда заболеваний (туберкулёза,ревматоидных артритов и т. д.). Радиоактивное золото используют при лечении злокачественных опухолей
Цены на золото
В 1792 в США было установлено, что 1 унция золота будет стоить 19,3 $. В 1834 году за унцию давали уже 20,67 $, поскольку США не имели достаточного золотого запаса, чтобы обеспечить весь объём выпущенных денег, и курс валюты приходилось снижать.
После Первой мировой войны девальвация продолжалась. В 1934 году за 1 унцию золота давали 35 $. Несмотря на экономический кризис, США пытались сохранить фиксированную привязку доллара к золоту, ради этого поднималась учётная ставка, но это не помогло. Однако в связи с последовавшими войнами золото из Старого Света стало перемещаться в Новый, что восстановило на время привязку доллара к золоту.
В 1944 было принято Бреттон-Вудское соглашение. Был введен золотодевизный стандарт, основанный на золоте и двух валютах — долларе США и фунте стерлингов Великобритании, что положило конец монополии золотого стандарта. Согласно новым правилам, доллар становился единственной валютой, напрямую привязанной к золоту. Казначейство США обязывалось обменивать доллары на золото иностранным правительственным учреждениям и центральным банкам в соотношении 35 $ за тройскую унцию. Фактически золото превратилось из основной в резервную валюту.
В конце 1960-х годов высокая инфляция в США вновь сделала невозможным сохранение золотой привязки на прежнем уровне, ситуацию осложнял и внешнеторговый дефицит США. Рыночная цена золота стала ощутимо превышать официально установленную. В 1971 содержание золота в долларе было снижено до 38 $ за унцию, а в 1973 — до 42,22 $ за унцию. В 1971 президент США Ричард Никсон отменил привязку доллара к золоту, хотя официально этот шаг был подтвержден лишь в 1976, когда была создана так называемая ямайская валютная система плавающих курсов. Это означало, что доллар больше не был обеспечен ничем, кроме долговых обязательств США.
После этого золото превратилось в особый инвестиционный товар. Инвесторы на протяжении многих лет доверяли исключительно золоту. К концу 1974 цены на золото подскочили до 195 $ за унцию, а к 1978 — до 200 $ за унцию. К началу 1980 года цена на золото достигло рекордной отметки — 850 $ за унцию (свыше 2000 в ценах 2008 года), после чего она начала постепенно падать. В конце 1987 года она составляла около 500 $ за унцию. Самое быстрое падение произошло в 1996—1999 гг., когда цена на золото снизилась с 420 до 260 $ за унцию.
Как бы то ни было, падение прекратилось и снова начался рост цены на золото в связи с соглашением ведущих центральных банков об ограничении продаж золота в 1999 году. К концу 2006 года цена на унцию золота достигла 620 $, а к концу 2007 года уже около 800 $. В начале 2008 года цена золота превысила рубеж в 1000 долларов за унцию. Тем не менее, в сравнимых ценах золото не дошло до пика 80х — выше 2000$. В середине октября 2009 года цена золота колебалась в пределах 1060 $ — 1070 $ за тройскую унцию.[4]
Золото для инвестиций выступает в нескольких формах — золотые слитки, золотые монеты, золотой песок. Инвестиционные монеты являются лучшим средством для инвестиций в РФ: покупатель не платит НДС. Тем не менее, цена за 1 грамм золота в монетах в России превышает цену 1 грамма в слитках даже с учетом НДС и процентов на спред последнего (например, в Сбербанке РФ). В отличие от аукционов E-bay, где стоимость чётко коррелирует с мировой ценой. Золото в монетах чеканки Uncirculated (название чеканки для инвестиционных монет) может стоить на 20-30 % дороже золота в слитках 50 или 100 граммовых, даже с учетом того, что за золото в слитке платится 18 % НДС и проценты так называемого «спреда» банку (около 2 % на покупку золота банком и 2 % на его продажу Вам, то есть в сумме около 4 % помимо НДС).
Кроме того, динамика цен на золото является важнейшим экономическим индикатором, позволяя оценить склонность инвесторов к риску. Зачастую можно наблюдать, что цена на золото и фондовые индексы движутся в противофазе, так как в периоды неустойчивой экономической ситуации инвесторы предпочитают консервативные активы, защищенные от полного обесценивания. И наоборот, когда ожидания роста экономики становятся оптимистичнее, аппетиты к повышенной доходности растут, заставляя котировки жёлтого металла снижаться.
Золотой запас России
Запасы золота в государственном резерве России в декабре 2008 г. составили 495,9 тонн (2,2 % от всех государств мира).[5] Доля золота в общем объёме золотовалютных резервов России в марте 2006 составила 3,8 %. Россия занимает 9 место в мире по объёму золота, находящегося в государственном резерве.
Уровень международных резервов
Государства с наибольшими международными резервами.
|
В десятке данных стран находится более 50 процентов от общих международных резервов мира.
Меры чистоты золота
Британская каратная система
Традиционно чистота золота измеряется в британских каратах. 1 британский карат равен одной двадцать четвёртой части массы сплава. 24-каратное золото (24K) является чистым, без каких-либо примесей.
Чтобы изменить качественные характеристики золота, для различных целей (например, увеличить твёрдость) изготавливают сплавы с различными примесями. Например, 18-каратное золото (18K) означает содержание в сплаве 18 частей золота и 6 частей примесей.
Российская система проб
Принятая в России система отличается от британской и аналогична принятой в Германии. В России чистота золота измеряется пробой.
Проба варьируется от 0 до 1000 и показывает содержание золота в тысячных долях. Так, 18-каратное золото соответствует 750-й пробе. Золото 999,96-й пробы считается «практически чистым», именно такой пробы оно и бывает в слитках. Золото 999,99 пробы крайне дорого в получении и употребляется только в химии. В отечественной ювелирной промышленности изготавливаются ювелирные изделия из золота 375, 500, 585, 750, 900, 916 и 958 пробы. По просьбе физического лица пробирная инспекция может поставить 583 пробу, хотя во многих странах бывшего СССР отказались от 583 пробы и оставили 585,например в Латвии.
Периодическая система химических элементов Менделеева:
|
IA |
IIA |
IIIB |
IVB |
VB |
VIB |
VIIB |
---- |
VIIIB |
---- |
IB |
IIB |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
| Период | ||||||||||||||||||
| 1 |
1
H |
2
He |
||||||||||||||||
| 2 |
3
Li |
4
Be |
5
B |
6
C |
7
N |
8
O |
9
F |
10
Ne |
||||||||||
| 3 |
11
Na |
12
Mg |
13
Al |
14
Si |
15
P |
16
S |
17
Cl |
18
Ar |
||||||||||
| 4 |
19
K |
20
Ca |
21
Sc |
22
Ti |
23
V |
24
Cr |
25
Mn |
26
Fe |
27
Co |
28
Ni |
29
Cu |
30
Zn |
31
Ga |
32
Ge |
33
As |
34
Se |
35
Br |
36
Kr |
| 5 |
37
Rb |
38
Sr |
39
Y |
40
Zr |
41
Nb |
42
Mo |
(43)
Tc |
44
Ru |
45
Rh |
46
Pd |
47
Ag |
48
Cd |
49
In |
50
Sn |
51
Sb |
52
Te |
53
I |
54
Xe |
| 6 |
55
Cs |
56
Ba |
* |
72
Hf |
73
Ta |
74
W |
75
Re |
76
Os |
77
Ir |
78
Pt |
79
Au |
80
Hg |
81
Tl |
82
Pb |
83
Bi |
(84)
Po |
(85)
At |
86
Rn |
| 7 |
87
Fr |
88
Ra |
** |
(104)
Rf |
(105)
Db |
(106)
Sg |
(107)
Bh |
(108)
Hs |
(109)
Mt |
(110)
Ds |
(111)
Rg |
(112)
Cp |
(113)
Uut |
(114)
Uuq |
(115)
Uup |
(116)
Uuh |
(117)
Uus |
(118)
Uuo |
| 8 |
(119)
Uue |
(120)
Ubn |
||||||||||||||||
| Лантаноиды * |
57
La |
58
Ce |
59
Pr |
60
Nd |
(61)
Pm |
62
Sm |
63
Eu |
64
Gd |
65
Tb |
66
Dy |
67
Ho |
68
Er |
69
Tm |
70
Yb |
71
Lu |
|||
| Актиноиды ** |
89
Ac |
90
Th |
91
Pa |
92
U |
(93)
Np |
(94)
Pu |
(95)
Am |
(96)
Cm |
(97)
Bk |
(98)
Cf |
(99)
Es |
(100)
Fm |
(101)
Md |
(102)
No |
(103)
Lr |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | ---- | VIIIB | ---- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |